MHRA Approva CASGEVY™ per l’Anemia Falciforme e la Beta Talassemia Trasfusione Dipendente, Segnando una Pietra Miliare nella Medicina di Precisione
Data: 7 Dicembre 2023
Introduzione: in una mossa storica che segna una nuova era nell’innovazione medica, Vertex Pharmaceuticals e CRISPR Therapeutics hanno ricevuto l’autorizzazione per la rivoluzionaria terapia di editing genico CRISPR/Cas9, CASGEVY™ [exagamglogene autotemcel (Exa-cel)], dall’Agenzia Regolatoria per i prodotti medici e sanitari del Regno Unito (MHRA). Questa terapia all’avanguardia è destinata a trasformare il panorama del trattamento per gli individui affetti da Anemia Falciforme (SCD) e da Beta Talassemia Trasfusione Dipendente (TDT).
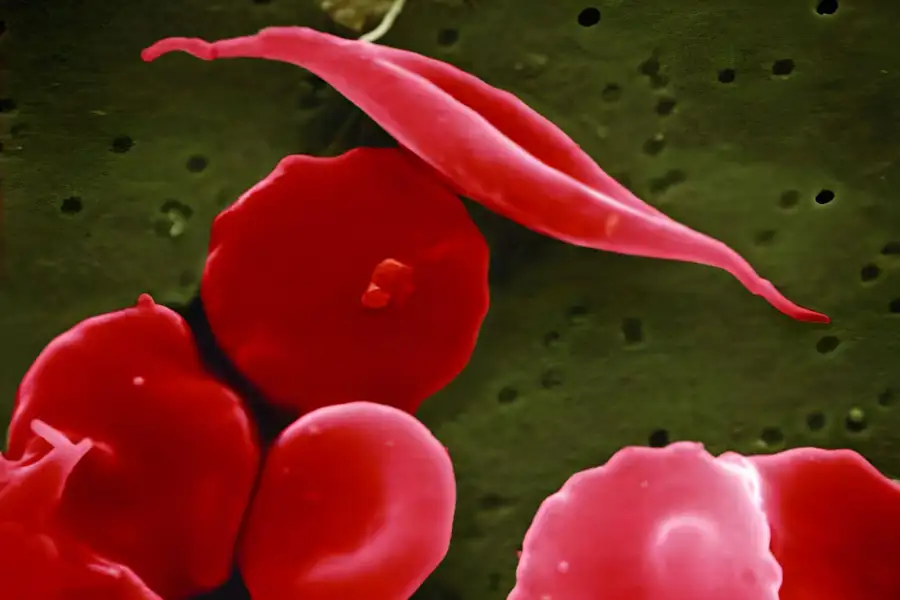
CASGEVY è stato autorizzato per il trattamento di pazienti di età pari o superiore a 12 anni affetti da SCD con crisi vaso-occlusive ricorrenti (VOC) o TDT senza un donatore di cellule staminali ematopoietiche compatibile con l’antigene leucocitario umano (HLA). Si stima che più di 2.000 pazienti nel Regno Unito siano idonei per CASGEVY.
Una Decisione Epocale:
L’approvazione della MHRA segna la prima autorizzazione al mondo per la terapia di editing genico CRISPR/Cas9. CASGEVY™ offre una speranza concreta per i pazienti che soffrono di queste problematiche ematologiche, aprendo nuove possibilità per trattamenti efficaci e precisi.
Secondo Reshma Kewalramani, M.D., Amministratore Delegato e Presidente di Vertex: “Oggi è un giorno storico per la scienza e la medicina: l’ autorizzazione di CASGEVY in Gran Bretagna è la prima autorizzazione al mondo per una terapia basata su CRISPR.”
La Scienza dietro CASGEVY™:
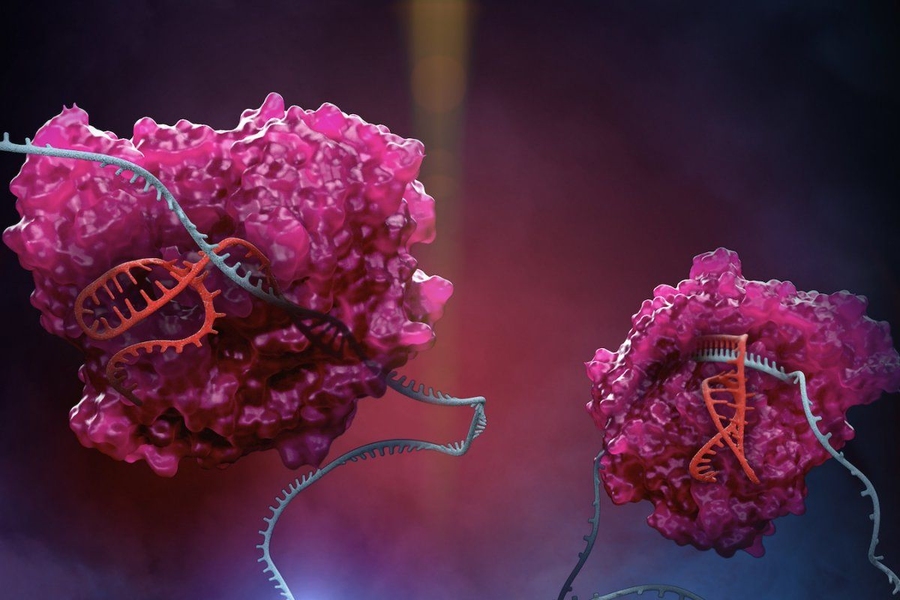
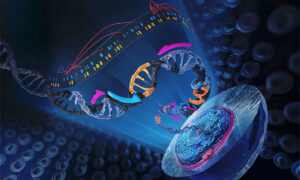
CASGEVY™ è una popolazione autologa geneticamente modificata arricchita di cellule CD34+ che contiene cellule staminali emopoietiche umane e cellule progenitrici, a loro volta modificate ex vivo da CRISPR/Cas9 nella regione enhancer eritroide specifica del gene BCL11A.
Un elevato livello di emoglobina fetale eritrocitaria (HbF), che comprende α- e γ-globine, può migliorare la sintomatologia mitigando la polimerizzazione dell’emoglobina malata e la falcizzazione degli eritrociti. BCL11A agisce come un repressore dell’espressione di γ-globine e della produzione di HbF negli eritrociti adulti: la sua sottoregolazione rappresentava una possibile strategia terapeutica per l’induzione di HbF.
Benefici per i Pazienti:
- Potenzialmente Curativo: CASGEVY™ è progettato per essere un trattamento potenzialmente curativo in un’unica somministrazione. Affrontando le cause genetiche alla base di queste malattie, offre un approccio trasformativo alle cure dei pazienti.
- Riduzione della Dipendenza dalle Trasfusioni: Per gli individui affetti da TDT, CASGEVY™ ha il potenziale di ridurre significativamente o eliminare del tutto la necessità di trasfusioni di sangue, migliorando sia la qualità della vita sia gli esiti di salute a lungo termine.
- Miglioramento della Qualità della Vita: I pazienti affetti da Anemia Falciforme affrontano spesso dolore cronico, danni agli organi e una serie di altre complicazioni. CASGEVY™ promette di alleviare questi sintomi, offrendo ai pazienti la possibilità di una vita più sana e appagante.
Implicazioni Globali:
L’autorizzazione di CASGEVY™ costituisce un precedente per gli enti regolatori in tutto il mondo. Il successo della terapia potrebbe aprire la strada a una maggiore accettazione delle tecnologie di editing genico nel campo medico, inaugurando una nuova era nella medicina di precisione.
Secondo Samarth Kulkarni, Ph.D., Presidente e Amministratore Delegato di CRISPR Therapeutics: “Spero che questa rappresenti la prima di molte applicazioni di questa tecnologia vincitrice del Premio Nobel, a beneficio dei pazienti idonei con malattie gravi.”
Sfide e Considerazioni:
Sebbene l’autorizzazione rappresenti un passo in avanti significativo, il monitoraggio continuo e la ricerca sono cruciali per comprendere l’efficacia a lungo termine e gli eventuali effetti collaterali di CASGEVY™. Come per ogni innovazione medica rivoluzionaria, la riflessione attenta su aspetti etici, di sicurezza e accessibilità rimane di primaria importanza.
Guardando al Futuro:
L’approvazione di CASGEVY™ rappresenta un traguardo monumentale nel campo della terapia genica, mostrando il potenziale della tecnologia CRISPR/Cas9 nel rivoluzionare i trattamenti medici. Vertex Pharmaceuticals e CRISPR Therapeutics si stanno ora preparando per la prossima fase: garantire l’accessibilità della terapia a coloro che ne trarranno il massimo beneficio.
L’autorizzazione della MHRA a CASGEVY™ per il trattamento di SCD e TDT segna un momento cruciale nella storia della medicina. Questa terapia rivoluzionaria è una testimonianza del potere della medicina di precisione e della ricerca incessante di soluzioni innovative nel trattamento di condizioni genetiche precedentemente incurabili. Mentre CASGEVY™ si posiziona al fronte delle più avanzate terapie mediche, la speranza è che non solo questa trasformi la vita dei singoli pazienti, ma apra la strada a un futuro in cui le tecnologie di editing genico diventino parte integrante dello standard di cura per una vasta gamma di altri disturbi genetici.