In un’importante svolta nel campo della ricerca oncologica, un gruppo di ricercatori ha sviluppato una potente piattaforma di screening intracellulare in grado di identificare peptidi inibitori covalenti capaci di disattivare in modo irreversibile i fattori di trascrizione oncogenici.
Un Nuovo Approccio per Bersagli “Undruggable”
I fattori di trascrizione, proteine chiave nella regolazione dell’espressione genica, rappresentano da tempo una sfida per lo sviluppo di farmaci. Queste proteine interagiscono con ampie superfici piatte di DNA o altre proteine, rendendo difficile per le piccole molecole farmaceutiche ottenere un legame efficace e selettivo.
Gli anticorpi, troppo grandi per penetrare nelle cellule, sono spesso inefficaci in questo contesto. Al contrario, i peptidi offrono un’alternativa ideale: abbastanza grandi da interagire con superfici proteiche estese, ma sufficientemente piccoli e flessibili da poter essere progettati per l’ingresso intracellulare.
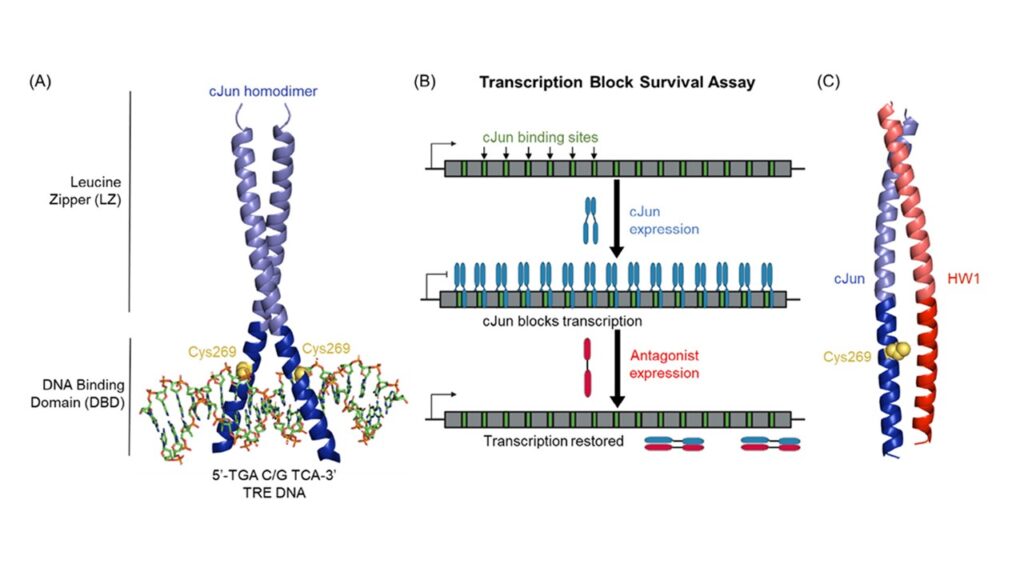
Uno dei fattori di trascrizione più rilevanti in oncologia è cJun, coinvolto nella progressione tumorale e nella resistenza terapeutica in numerosi tipi di cancro. Legandosi a specifiche sequenze di DNA, cJun attiva geni che favoriscono la proliferazione e la sopravvivenza cellulare. Bloccarne l’attività è considerato un approccio promettente per inibire la crescita tumorale a monte, a livello genetico.
Oltre il Legame: Il Saggio TBS (Transcription Block Survival)
Per affrontare questa sfida, i ricercatori hanno perfezionato un innovativo metodo di screening chiamato Transcription Block Survival (TBS). A differenza dei test tradizionali che si limitano a rilevare il legame tra molecola e bersaglio, TBS valuta se un peptide è effettivamente in grado di bloccare l’attività biologica del fattore di trascrizione all’interno della cellula.
Il principio è semplice ed elegante: delle cellule batteriche ingegnerizzate dipendono da un gene per sopravvivere, ma questo gene contiene delle sequenze a cui cJun si lega. Quando cJun è attivo, si lega al DNA e blocca l’espressione del gene, impedendo la crescita batterica. Se un peptide antagonista inibisce efficacemente cJun, la cellula può sopravvivere. In questo modo, la crescita cellulare diventa un indicatore diretto dell’efficacia dell’antagonista.
Grazie a questo sistema, in studi precedenti era stato identificato il peptide HW1, capace di bloccare in modo reversibile cJun. Ma l’obiettivo attuale era più ambizioso: creare un inibitore peptidico irreversibile.
La Chimica Giusta: Sfruttare una Cisteina Vulnerabile
L’attenzione si è concentrata su un residuo di cisteina specifico, Cys269, situato nel dominio di legame al DNA di cJun. Questo amminoacido, esposto in superficie, si presta alla formazione di legami disolfuro ed è considerato un interruttore redox naturale in grado di disattivare la funzione di cJun.
I ricercatori hanno costruito una libreria peptidica di oltre 131.000 varianti, ognuna delle quali includeva la possibilità di inserire una cisteina in posizioni strategiche. Lo scopo era formare un legame disolfuro con Cys269, bloccando irreversibilmente l’attività del fattore.
La libreria è stata testata in due ceppi batterici: uno con ambiente ossidante (favorente i legami disolfuro) e uno con ambiente riducente (che li inibisce). Solo in condizioni ossidanti è stato selezionato un peptide vincente, chiamato OxW, che conteneva una cisteina nel punto ideale per interagire con Cys269. Questo risultato ha confermato l’importanza funzionale della formazione del legame covalente.
Dal Disolfuro all’Irreversibilità: HW33
OxW è stato raffinato fino a ottenere il peptide HW31, stabilizzato strutturalmente tramite un ponte lattamico. HW31 ha dimostrato un’efficace inibizione funzionale di cJun tramite legame disolfuro.
Tuttavia, poiché i legami disolfuro sono reversibili e instabili in ambiente intracellulare, i ricercatori hanno modificato HW31 per renderlo irreversibile. Due strategie chimiche sono state testate: la sostituzione della cisteina con deidroalanina (peptide HW32) e l’uso di una reazione di alchilazione per ottenere HW33.
HW33 si è rivelato il più efficace: ha formato rapidamente un legame covalente permanente con cJun in meno di 5 minuti in vitro. Inoltre, la molecola non ha reagito con CREB1, un altro fattore di trascrizione simile a cJun, confermando l’elevata specificità del legame, guidata dalla precisa interazione tra peptide e bersaglio.
Dentro la Cellula: Verso un Candidato Terapeutico
Per valutare l’efficacia di HW33 in un sistema cellulare, è stato fuso con un peptide penetrante e una sequenza di localizzazione nucleare, ottenendo FAM-HW33-NLSTAT. Questo peptide modificato è stato in grado di penetrare nelle cellule di melanoma umano (SK-MEL-28).
Una volta all’interno, il peptide ha ridotto significativamente i livelli intracellulari di cJun e la vitalità cellulare. Gli effetti erano dose- e tempo-dipendenti, con una riduzione della viabilità cellulare superiore al 50% dopo 24 ore. Peptidi di controllo senza il gruppo reattivo o senza il vettore cellulare non hanno avuto alcun effetto.
Le analisi tramite Western blot hanno mostrato una forte riduzione della proteina cJun già dopo 6 ore di trattamento. Sebbene il meccanismo preciso non sia ancora chiarito, è probabile che il legame covalente acceleri la degradazione della proteina bersaglio.
Sorprendentemente, anche senza un’evidente localizzazione nucleare, il peptide ha mantenuto la sua efficacia, probabilmente intercettando cJun nel citoplasma prima che raggiunga il nucleo.
Una Piattaforma Versatile per la Scoperta di Nuovi Farmaci
Oltre ai risultati ottenuti con HW33, lo studio dimostra il potenziale più ampio della piattaforma TBS. Grazie a librerie peptidiche geneticamente codificate e al test in condizioni intracellulari ossidanti, è possibile identificare non solo inibitori funzionali, ma anche i residui di cisteina bersagliabili con legami covalenti.
Questo approccio è particolarmente utile quando mancano informazioni strutturali ad alta risoluzione sulla proteina bersaglio. Inoltre, essendo il processo svolto all’interno di cellule vive, i peptidi selezionati sono già ottimizzati per stabilità, specificità e compatibilità biologica.
Prospettive Future
Anche se questo studio si è focalizzato su cJun come modello, le sue implicazioni sono molto più ampie. Numerosi altri fattori di trascrizione e proteine legate a malattie contengono cisteine che potrebbero essere sfruttate in modo analogo. Con librerie personalizzate e vettori migliorati, la piattaforma TBS potrebbe portare allo sviluppo di una nuova classe di farmaci peptidici mirati.
Lo sviluppo di HW33 dimostra che è possibile progettare peptidi in grado non solo di legarsi con alta affinità e specificità, ma anche di formare legami covalenti irreversibili che potenziano l’effetto terapeutico. Per tale motivo, questo lavoro rappresenta un passo importante verso terapie mirate contro proteine finora considerate inaccessibili.
Paolo Rega


Lascia un commento