Di Paolo Rega
Nella battaglia ad alto rischio contro la tubercolosi e altre infezioni micobatteriche, gli scienziati stanno trovando un alleato inaspettato: dei virus che infettano i batteri, noti come batteriofagi. Uno studio rivoluzionario pubblicato su Cell da Krista Freeman e colleghi svela la struttura atomica e le dinamiche di infezione di uno di questi virus—il micobatteriofago Bxb1—offrendo nuove speranze per terapie fagiche di precisione e per le piattaforme vaccinali di nuova generazione.
La ricerca unisce tecniche all’avanguardia come la crio-microscopia elettronica (cryo-EM) e la crio-tomografia elettronica (cryo-ET) per fornire una visione senza precedenti di come Bxb1 si attacchi a e penetri in Mycobacterium smegmatis, un sostituto sicuro di Mycobacterium tuberculosis. Lo studio non è soltanto un tour de force di imaging molecolare, ma potrebbe tracciare la strada verso nuove applicazioni terapeutiche per infezioni resistenti agli antibiotici.
Un virus con uno scopo
Bxb1 non è un batteriofago qualunque. È un membro ben caratterizzato della famiglia degli actinobatteriofagi, con una comprovata utilità nell’ingegneria genetica e un grande potenziale nelle innovazioni biomediche. I ricercatori ne hanno a lungo ammirato la capacità di integrarsi nei genomi batterici—una caratteristica già sfruttata nella biologia sintetica. Ma fino ad ora, il meccanismo dettagliato con cui Bxb1 infetta il suo ospite restava un mistero.
Ingegneria e biologia: una sinfonia strutturale
Il team ha iniziato utilizzando la cryo-EM per congelare particelle di Bxb1 in azione, catturandole con un livello di dettaglio estremamente preciso. Al centro del fago c’è il suo capside, una struttura proteica icosaedrica larga circa 60 nanometri che contiene il materiale genetico. Questo capside è collegato a una lunga e flessibile coda—di circa 130 nanometri—che funge da sistema di consegna, guidando il DNA virale dentro l’ospite.
Ciò che rende Bxb1 veramente straordinario, però, è la sua architettura elaborata. Il virus è ricoperto da domini proteici chiamati estensioni C-terminali (C-terminal extensions, CTE), che decorano sia il capside che il tubo della coda. Queste CTE non solo stabilizzano la struttura, ma sono anche altamente immunogeniche, rendendole target promettenti per la presentazione di antigeni vaccinali.
Un aspetto ancora più interessante è il fatto che Bxb1 utilizza una combinazione di complessi proteici simmetrici—con simmetrie a 3, 5, 6 e 12—che si incastrano come pezzi di un puzzle complesso. Questo consente al virus di gestire transizioni sofisticate tra le sue parti, come il “portale” che collega il capside alla coda. È come se fosse una scatola del cambio molecolare che passa dalla modalità di impacchettamento a quella di consegna.
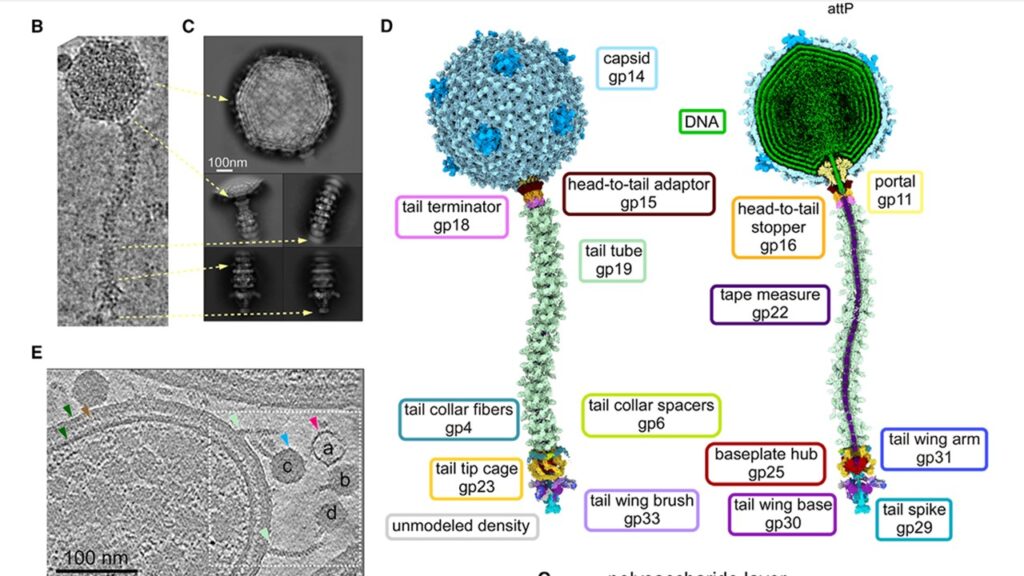
(D) Mappa composita ottenuta tramite cryo-EM dell’intera particella di Bxb1, con i segmenti di densità relativi a ciascun componente strutturale, debitamente etichettati e colorati. L’immagine a sinistra mostra il volume completo, quella a destra è sezionata per mostrare una sezione trasversale. (E) Sezione tomografica rappresentativa che mostra una cellula di M. smegmatis infettata da Bxb1. Sono indicati: la membrana micobatterica (freccia verde), lo strato di peptidoglicano/arabinogalattano (marrone), i capsidi contenenti DNA (blu), i capsidi vuoti (rosa) e il tubo della coda (verde chiaro); i capsidi sono contrassegnati da lettere.
La danza della punta per penetrare l’ospite
Uno dei momenti più sfuggenti—e critici—nella vita di un fago è quando infetta un ospite. Il team ha utilizzato la cryo-ET, una tecnica che cattura immagini 3D di fagi legati all’ospite nel momento esatto dell’infezione, per osservare questo passaggio in tempo reale. I ricercatori si sono concentrati sull’interazione tra la punta della coda di Bxb1 e la superficie batterica.
La punta della coda, si è scoperto, non è un ago statico. È una struttura dinamica composta da nove proteine, inclusa una sorta di “gabbia” specializzata che si apre come un fiore per interfacciarsi con la spessa e cerosa parete cellulare del micobatterio. Questa struttura si appiattisce in una forma a disco mentre il fago si lega, infilandosi la membrana esterna.
Il team ha anche rilevato segnali di attività enzimatica. Una componente della coda, chiamata gp30, sembra contenere un dominio carbossipeptidasico D-alanil-D-alanina—uno strumento che probabilmente aiuta a digerire la parete cellulare batterica per creare un passaggio al DNA virale.
Osservare l’infezione in diretta
Grazie alle istantanee della cryo-ET catturate in diversi stadi, i ricercatori sono riusciti a distinguere tra i virioni ancora pieni di DNA e quelli che lo avevano già iniettato. Sorprendentemente, il tubo della coda agisce come un condotto, e piccoli cambiamenti—come la scomparsa di una proteina chiamata “tape measure protein” (TMP)—segnalano l’inizio del trasferimento del materiale genetico.
Questa osservazione diretta dell’iniezione del DNA è una pietra miliare. Dimostra che l’espulsione del genoma non richiede una ristrutturazione massiccia del corpo del fago. Piuttosto, è come aprire una valvola in un sistema già pronto.
Un cavallo di Troia per i vaccini?
Oltre al suo meccanismo infettivo, Bxb1 è anche oggetto di studi come veicolo di presentazione per antigeni vaccinali. Le sue CTE potrebbero servire da piattaforme per esporre proteine estranee che attivano il sistema immunitario.
Tuttavia, lo studio ha evidenziato anche dei limiti: sebbene le CTE possano essere rimosse, non possono essere facilmente sostituite con antigeni ingombranti senza destabilizzare la struttura. I ricercatori propongono una soluzione: usare linker flessibili o co-esprimere proteine stabilizzanti per mantenere l’integrità dello scheletro virale.
Lo scenario più ampio: verso la terapia fagica
Bxb1 è solo uno degli oltre 2.600 micobatteriofagi sequenziati, ma è il primo a essere caratterizzato in modo così completo livello atomico. Comprendere come i fagi come Bxb1 infettino i batteri potrebbe aprire la strada a cocktail fagici mirati per trattare infezioni resistenti agli antibiotici, soprattutto nei casi in cui questi ultimi falliscono nel loro effetto terapeutico.
E non è fantascienza. La terapia fagica compassionevole ha già salvato vite in alcuni casi di tubercolosi e Mycobacterium abscessus. Tuttavia, adattare i fagi a ceppi batterici specifici resta una sfide che studi strutturali come questo potrebbero aiutare a superare.


Lascia un commento